LA QUÍMICA DEL CARBONO
EL ORIGEN DE
LA QUÍMICA ORGÁNICA
El término
“química orgánica" fue introducido en 1807 por Jöns Jacob Berzelius, para
estudiar los compuestos derivados de recursos naturales. Se creía que los
compuestos relacionados con la vida poseían una “fuerza vital” que les hacía
distintos a los compuestos inorgánicos, además se consideraba imposible la
preparación en el laboratorio de un compuesto orgánico, lo cual se había
logrado con compuestos inorgánicos.
En 1823,
Friedrich Wöhler, completó sus estudios de medicina en Alemania y viajó a
Estocolmo para trabajar bajo la supervisión de Berzelius.
En 1928,
Wöhler observó al evaporar una disolución de cianato de amonio, la formación de
unos cristales incoloros de gran tamaño, que no pertenecían al cianato de
amonio.
El análisis de
los mismos determinó que se trataba de urea. La transformación observada por
Wöhler convierte un compuesto inorgánico, cianato de amonio, en un compuesto
orgánico, la urea, aislada en la orina de los animales.
Este
experimento fue la confirmación experimental de que los compuestos orgánicos
también pueden sintetizarse en el laboratorio.
Química Orgánica
La química
orgánica es la disciplina científica que estudia la estructura, propiedades,
síntesis y reactividad de compuestos químicos formados principalmente por
carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente
en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo,
silicio.
El término
“orgánico” procede de la relación existente entre estos compuestos y los
procesos vitales, sin embargo, existen muchos compuestos estudiados por la
química orgánica que no están presentes en los seres vivos, mientras que
numerosos compuestos inorgánicos forman parte de procesos vitales básicos,
sales minerales, metales como el hierro que se encuentra presente en la
hemoglobina.
Los compuestos
orgánicos presentan una enorme variedad de propiedades y aplicaciones y son la
base de numerosos compuestos básicos en nuestras vidas, entre los que podemos
citar: plásticos, detergentes, pinturas, explosivos, productos farmacéuticos,
colorantes, insecticidas.
La síntesis de
nuevas moléculas nos proporciona nuevos tintes para dar color a nuestras ropas,
nuevos perfumes, nuevas medicinas con las que curar enfermedades. Por desgracia
existen compuestos orgánicos que han causado daños muy importantes,
contaminantes como el DDT, fármacos como la Talidomida. Pero desde mi punto de
vista el balance de esta disciplina científica es más que positivo, hasta el
punto de ser imposible el nivel de vida actual sin sus aportaciones.
Tomado
de: El origen de la química orgánica. http://www.quimicaorganica.org/component/content/article/30/57-el-origen-de-la-quimica-organica.html
El
Átomo de Carbono
La vida en
nuestro planeta es posible gracias a dos fenómenos que constituyen una rareza
en el mundo de la química: el puente de hidrógeno y la catenación del carbono.
En el caso de
la molécula de agua, H2O, el puente de hidrógeno es una fuerza de atracción que
ocurre entre el hidrógeno de una molécula, y el oxígeno de otra molécula. Esta
atracción se debe a que el hidrógeno es electropositivo, y el oxígeno es
electronegativo. Sin el puente de hidrógeno, el agua no podría existir en
estado líquido o sólido a la temperatura ambiental de la Tierra. Sería un gas,
al igual que todos los compuestos cuyas moléculas tienen un peso molecular tan
bajo como el del agua.
Por otro lado,
la catenación es la capacidad de un elemento para formar cadenas; es decir,
para unirse químicamente consigo mismo. El carbono no es el único elemento que
tiene esta capacidad, pero es el que más tiende a hacerlo, y en las formas más
variadas.
El símbolo del
átomo de carbono es “C”. En el idioma español, no es lo mismo “carbono” que
“carbón”. “Carbono” es el nombre del elemento, y “carbón” es un sólido formado
principalmente por cadenas de átomos de carbono. El carbono que se encuentra en
la Tierra, se creó hace unos 5000 millones de años, durante el periodo de
formación del sistema solar, en el que prevaleció la química de fusión nuclear,
y mostró ser relativamente estable. Esto le permitió aportar una cantidad que
representa el 0.02% en peso de todos los elementos. Aunque este porcentaje
parece bajo, el carbono es el décimo segundo elemento más abundante en nuestro
planeta.
El carbono
pertenece al grupo 14 de la tabla periódica, cuyos elementos son: carbono (C),
silicio (Si), germanio (Ge), estaño (Sb) y plomo (Pb). Los primeros tres son no
metales, y los últimos dos son metales. Todos estos elementos comparten la
capacidad de catenación, pero ninguno de ellos lo hace con tanta facilidad como
el carbono.
Además de
concatenarse, el carbono puede hacerlo mediante enlazamiento múltiple, lo que
significa enlazarse entre sí mediante enlaces dobles y triples. Esta última
propiedad es común al nitrógeno y al oxígeno, pero en dichos casos, la
catenación es relativamente poco frecuente.
Los átomos de
carbono pueden unirse entre sí en una variedad de formas y en una cantidad de
átomos, imposible para cualquier otro elemento. Pueden formar cadenas de miles
de átomos o anillos de todos los tamaños; estas cadenas y anillos pueden tener
ramificaciones. A los carbonos de estas cadenas y anillos se unen otros átomos;
principalmente hidrógeno, oxígeno, flúor, cloro, bromo, yodo, nitrógeno,
azufre, fósforo.
Esta
particular característica es la que permite que existan tantos compuestos de
carbono. El número de compuestos que contienen carbono es varias veces mayor
que el número de sustancias que no lo contienen.
Durante la
formación de la Tierra, su atmósfera se componía principalmente de vapor de
agua, dióxido de carbono y nitrógeno, junto con otros gases emitidos por la
acción volcánica. La vida inició con los vegetales hace unos 3000 millones de
años, en las aguas tibias de los océanos y los mares, y originalmente en formas
de plantas primitivas. Esta forma de vida evolucionó debido a su habilidad para
fotosintetizar, tomando como materia prima el dióxido de carbono de la
atmósfera, y reemplazándolo por oxígeno. En el proceso de fotosíntesis, la
planta convierte el CO2 en las cadenas de celulosa y demás moléculas que la
conforman, y que, como veremos adelante, los químicos han denominado moléculas
orgánicas.
Las primeras
formas de plantas y algas crecieron en una abundancia masiva a lo largo de
millones de años. Las formas de vida animal evolucionaron mucho después,
probablemente hace alrededor de 2000 millones de años, y fueron totalmente
dependientes del oxígeno generado por la flora de ese tiempo.
Los animales herbívoros
se alimentan de plantas, y los animales carnívoros se alimentan de otros
animales. Por lo tanto, todos los seres vivos, plantas y animales, partimos del
CO2 como materia prima para formar nuestros tejidos. Podemos estar conscientes,
entonces, de que todos nuestros tejidos fueron CO2.
El principal
compuesto presente en el cuerpo humano es el agua, pero en segundo lugar están
las moléculas orgánicas a base de cadenas de carbono. Por lo tanto, el oxígeno
representa la mayor parte de la masa del cuerpo humano (65%), pero en segundo
lugar está el carbono (18%). El 99 % de la masa del cuerpo humano está formada
por seis elementos: oxígeno, carbono, hidrógeno, nitrógeno, calcio, y fósforo.
El contenido de los elementos aluminio y silicio, aunque son muy abundantes en
la Tierra, es muy bajo en el cuerpo humano.
La
formación de los yacimientos de petróleo, y de las minas de carbón
El petróleo y
el gas natural son compuestos orgánicos que se formaron a partir de la materia
orgánica acumulada en sedimentos del pasado geológico, y en asociación con
materia inorgánica de los mares a lo largo de millones de años.
Por otro lado,
hace alrededor de 500 millones de años, la flora había evolucionado
considerablemente, y pasó de las aguas tibias de los mares, a la tierra. Al
entrar en la era carbonífera, ocurrió un crecimiento masivo en la forma de
selvas tropicales. En este tiempo, también los continentes se dirigían
lentamente hacia el norte, a través de los climas más cálidos de las regiones
ecuatoriales, con sus tormentas torrenciales. El desplazamiento continental con
las depresiones y levantamientos correspondientes de la corteza terrestre,
provocaron que áreas crecientes de estas selvas tropicales, lentamente y a
través de millones de años, quedaran sumergidas en estuarios de ríos y en el
mar. No todos los árboles de las selvas que crecieron a lo largo de un periodo
de alrededor de 300 millones de años formaron minas de carbón. Probablemente
solo uno de cada mil billones (1 x 1015) de árboles terminó en una mina de carbón.
El resto, simplemente se descompuso en compuestos gaseosos y minerales.
Una importante
etapa en la formación de carbón, a partir del material de estas selvas
tropicales, fue el pantano, con su materia botánica descompuesta por bacterias
aeróbicas y anaeróbicas, para crear el material residual que se convirtió en
carbones, bajo subsecuentes influencias de tiempo, temperatura y presión,
asociadas al entierro de material, normalmente a distancias profundas.
Este proceso
de carbonización continuó debajo de la tierra, mientras que los continentes se
movían hacia el norte hasta la posición en la que se encuentran actualmente.
Las propiedades de los carbones de las distintas zonas carboníferas del mundo
no son idénticas, incluyendo los carbones que se encuentran a diferentes
niveles dentro de una misma beta. Algunos carbones se formaron mucho tiempo
después de que había terminado la era carbonífera; es decir, en el periodo
cretáceo, asociado con los dinosaurios.
Los carbones
más viejos o más maduros son las antracitas, y que esencialmente no se funden
al calentar. Los carbones minerales, es decir, los de edad intermedia, se
funden al calentar. Estos carbones son los que se utilizan para fabricar coque
metalúrgico para las industrias de producción de fierro y acero.
Los carbones
más jóvenes son los lignitos y los carbones marrones, que son relativamente
ricos en oxígeno e hidrógeno.
Por lo tanto,
las materias primas de la industria del carbón se asocian claramente con los
minerales fósiles del mundo. Debido al extenso rango de condiciones geológicas
que existieron en la formación, tanto de petróleo como de carbón, se entiende
que estos materiales exhiben considerable variación en sus propiedades físicas
y químicas. Dichas diferencias llevan a distintos usos de estos materiales,
particularmente en las industrias de producción de fierro y aluminio.
Los
Alótropos del Carbón
La alotropía
es la propiedad de algunas sustancias simples de poseer estructuras moleculares
diferentes. Las moléculas formadas por un solo elemento y que poseen distinta
estructura molecular se llaman alótropos.
A lo largo de
gran parte de la historia se han conocido dos alótropos comunes del carbono: el
grafito y el diamante.
Diamánte
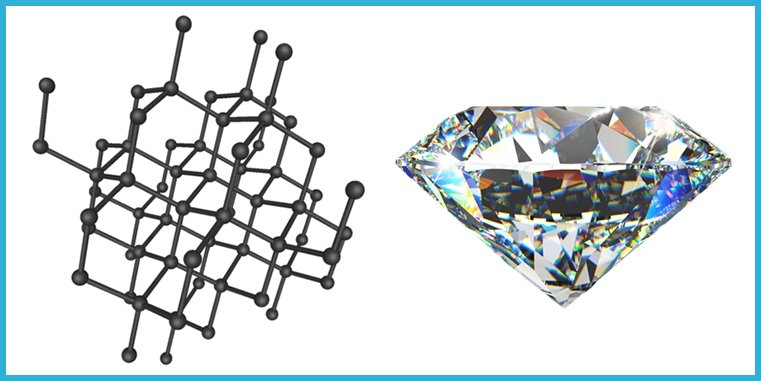 Ambos son
cristalinos, (es decir, están formados por una estructura molecular ordenada) y
los átomos están enlazados con enlaces fuertemente covalentes. Sin embargo,
recientemente se ha identificado toda una nueva familia de alótropos, como los
fulerenos.
Ambos son
cristalinos, (es decir, están formados por una estructura molecular ordenada) y
los átomos están enlazados con enlaces fuertemente covalentes. Sin embargo,
recientemente se ha identificado toda una nueva familia de alótropos, como los
fulerenos.
El diamante
tiene una estructura tetrahédrica, en la que cada átomo de carbono está unido a
otros cuatro mediante enlaces covalentes. Es decir, sus cristales forman un
volumen en las tres dimensiones espaciales: largo, ancho y profundo. La
estabilidad del enlace entre sus átomos, le da características muy
particulares: es el material natural de mayor dureza en la Tierra; su
estabilidad impide que los electrones de desplacen a través de él, por lo que
es un aislante eléctrico; no obstante, la unión tan rígida entre sus átomos lo
hacen un excelente conductor térmico: alrededor de cinco veces mejor que el
cobre (y esto es así porque la vibración de un átomo que recibe calor, se
transmite a los otros con gran eficiencia, debido a la rigidez de la
estructura). Su densidad es de 3.5 g/cm3.
Grafito
La estructura
del grafito es muy diferente de la del diamante. El grafito se compone de
láminas de átomos de carbono llamadas “grafeno”, paralelas entre sí. La
distancia entre las láminas de carbono es relativamente grande, por lo que la
atracción entre las capas es muy débil. Esto explica sus propiedades más
interesantes: capacidad para conducir la electricidad, debido a que los
electrones se desplazan a lo largo de las placas; es un excelente lubricante
debido a que las láminas de átomos de carbono pueden deslizarse unas sobre
otras; adsorbe (atrapa por atracciones intermoleculares) moléculas de gas entre
las capas. Por esta razón, muchos químicos argumentan que en realidad las
láminas de grafito se deslizan sobre “rodamientos de bolas”, que son las moléculas
de gas.
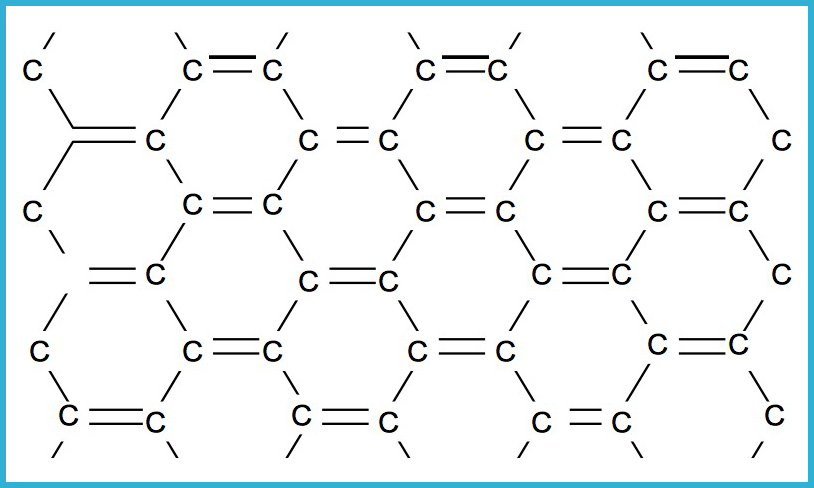 El grafito se
emplea en lubricantes, como electrodo y como mezclas de grafito y arcilla en
los lápices de mina. Cuanto mayor es la proporción de arcilla, más “duro” es el
lápiz. La mezcla ordinaria se designa como “HB”. Las mezclas con más arcilla
(más duras) se designan por medio de diversos números “H”, por ejemplo, “2H”, y
a las mezclas con mayor contenido de grafito (más suaves) se les asignan
diversos números “B”.
El grafito se
emplea en lubricantes, como electrodo y como mezclas de grafito y arcilla en
los lápices de mina. Cuanto mayor es la proporción de arcilla, más “duro” es el
lápiz. La mezcla ordinaria se designa como “HB”. Las mezclas con más arcilla
(más duras) se designan por medio de diversos números “H”, por ejemplo, “2H”, y
a las mezclas con mayor contenido de grafito (más suaves) se les asignan
diversos números “B”.
El grafito
puede convertirse en diamante a altas presiones (50,000 atmósferas) y
temperaturas (1600oC). De hecho, es un proceso que se aplica industrialmente.
Los diamantes obtenidos no tienen las características estéticas adecuadas para
usarse como gemas, pero se aplican en brocas para barrenar materiales muy
duros.
 El
descubrimiento de una nueva serie de alótropos de carbono debe considerarse
como un hallazgo inesperado. Los fulerenos constituyen una familia de
estructuras en las que los átomos de carbono están organizados en una
estructura esférica o elipsoidal. Para construir este tipo de estructuras, los
átomos de carbono forman anillos de cinco y de seis miembros, en un patrón
similar a las líneas de un balón de fútbol (el primer nombre que se dio al C60
fue futboleno). La esfera de 60 miembros, C60, el buckminsterfulereno, es el
más fácil de preparar y, desde el punto de vista estético, el más bello, pues
es una esfera perfecta. La esfera de 70 miembros, C70, es el siguiente fulereno
común disponible. La estructura elipsoidal de este alótropo se asemeja a un
balón de fútbol americano o de rugby.
El
descubrimiento de una nueva serie de alótropos de carbono debe considerarse
como un hallazgo inesperado. Los fulerenos constituyen una familia de
estructuras en las que los átomos de carbono están organizados en una
estructura esférica o elipsoidal. Para construir este tipo de estructuras, los
átomos de carbono forman anillos de cinco y de seis miembros, en un patrón
similar a las líneas de un balón de fútbol (el primer nombre que se dio al C60
fue futboleno). La esfera de 60 miembros, C60, el buckminsterfulereno, es el
más fácil de preparar y, desde el punto de vista estético, el más bello, pues
es una esfera perfecta. La esfera de 70 miembros, C70, es el siguiente fulereno
común disponible. La estructura elipsoidal de este alótropo se asemeja a un
balón de fútbol americano o de rugby.
Esta familia
de alótropos se llama así en honor a R. Buckminster Fuller, un genio del siglo
XX. Su nombre se asocia en especial con el domo geodésico, un diseño arquitectónico
de enorme resistencia, que tiene el mismo arreglo estructural que la molécula
del C60.
 Los fulerenos
también pueden formar tubos con el mismo tipo de estructura (“buckitubos”).
Ahora que sabemos de la existencia de estas moléculas, las mismas surgen por
todas partes. El hollín ordinario contiene fulerenos, y se les ha encontrado en
depósitos naturales de grafito. Algunos astroquímicos arguyen que estas
moléculas existen en gran abundancia en el espacio interestelar.
Los fulerenos
también pueden formar tubos con el mismo tipo de estructura (“buckitubos”).
Ahora que sabemos de la existencia de estas moléculas, las mismas surgen por
todas partes. El hollín ordinario contiene fulerenos, y se les ha encontrado en
depósitos naturales de grafito. Algunos astroquímicos arguyen que estas
moléculas existen en gran abundancia en el espacio interestelar.
La química de estas novedosas
moléculas es hoy día campo de investigación intensa, y las moléculas ya están
disponibles en el comercio.
ALCANOS O HIDROCARBUROS SATURADOS
Son compuestos formados por
carbono e hidrógeno en los que no existe ningún doble o triple enlace en la
cadena de átomos de carbono. Se obtienen del gas natural, del petróleo y de la
destilación de la hulla.
Todos los átomos de carbono
utilizan hibridación sp3 y, debido a la disposición tetraédrica alrededor del
átomo de carbono que corresponde a esta hibridación, las moléculas de los
hidrocarburos presentan un aspecto de cadena en zigzag.
Son poco polares porque la
diferencia entre la electronegatividad del carbono y la del hidrógeno es muy
pequeña. Como consecuencia de su pequeña polaridad son insolubles en agua, pero
son solubles los unos en los otros y también en disolventes orgánicos como
éter, tetracloruro de carbono y benceno.
Su reacción más característica
es la combustión en presencia de oxígeno que es fuertemente exotérmica por lo
que se utilizan como combustibles.
Los alcanos de cadena abierta o
lineal tienen como fórmula general CnH2n+2 y para nombrarlos de acuerdo a las
normas de la IUPAC se indica mediante una raíz el número de átomos de carbono
seguida de la terminación ano característica de los hidrocarburos saturados.
El número de átomos de carbono,
la raíz, se indica mediante un prefijo tal como se muestra en la tabla
siguiente.
Uso de los alcanos
La principal fuente de
hidrocarburos, entre estos alcanos, es el petróleo, del que constituyen
aproximadamente el 90%. Se obtienen por destilación fraccionada del petróleo
crudo. El petróleo brota en forma espontánea, pero de no ser así, es necesario
extraerlo con bombas. Los métodos de perforación pueden ser de rotación o
percusión.
1 1) El metano, etano, propano y
le butano, son gases combustibles que son muy empleados para calentamiento.
2) El propano y el butano
forman el combustible doméstico.
3) El butano y el
2-metilpropano forman el combustible usado en encendedores.
4) El pentano, el decano, el
hexano y el ciclo hexano son algunos alcanos que forman la gasolina.
5) El éter de petróleo o
ligroina se emplea como disolvente y para el lavado en seco.
6) El queroseno, que hoy en día
se usa como combustible para calentadores
7) El diesel se emplea como
combustible en motores.
8) Los aceites lubricantes y la
vaselina se usan para lubricantes.
9) Las ceras de parafina se
usan para elaborar velas, cerillo e impermeabilizantes.
10) El asfalto es utilizado
para pavimentación y recubrimientos.
11) El coque de petróleo se usa
para elaborar electrodos de carbón.
Los alcanos también se usan
como disolventes en removedores de pintura y pegamentos, y constituyen la
materia prima para elaborar infinidad de compuestos orgánicos sintéticos.
ALQUENOS
Los alquenos son hidrocarburos
que contienen enlaces dobles carbono-carbono. Se emplea frecuentemente la palabra
olefina como sinónimo.
Los alquenos abundan en la
naturaleza. El eteno, es un compuesto que controla el crecimiento de las
plantas, la germinación de las semillas y la maduración de los frutos.
Usos
de los alquenos
1) Ayuda a madurar las frutas y
verduras. Los tomates se almacenan verdes, y se someten a una atmósfera que contiene
etileno para conseguir que maduren y se vuelvan rojos antes de ponerlos a la
venta. También se utiliza para fabricar botellas de leche y refrescos.
2) Esta botella de detergente
contiene polipropileno (polímero), un plástico duro que se hace a partir del propeno.
3) Hizo posible la sustitución
del caucho natural por goma sintética.
LOS
ALQUINOS
Los alquinos son hidrocarburos
que contienen enlaces triples carbono-carbono. La fórmula molecular general
para alquinos acíclicos es CnH2n-2 y su grado de insaturación es dos. El
acetileno o etino es el alquino más simple, fue descubierto por Berthelot en
1862.
Los alquinos tienen unas
propiedades físicas similares a los alcanos y alquenos. Son poco solubles en agua, tienen una baja
densidad y presentan bajos puntos de ebullición. Sin embargo, los alquinos son más polares
debido a la mayor atracción que ejerce un carbono sp sobre los electrones,
comparado con un carbono sp3 o sp2.
Uso de los alquinos
1) El acetileno (etino) es el
alquino de mayor uso, el cual se utiliza en soldaduras.
2) En la industria química los
alquinos son importantes productos de partida por ejemplo en la síntesis del
PVC, de caucho artificial, etc.
3) El grupo alquino está
presente en algunos fármacos citostáticos.
4) Los polímeros generados a
partir de los alquinos, los polialquinos, son semiconductores orgánicos.
ACTIVIDADES PROGRAMADAS
Nota: Estas actividades deben ser entregadas al maestro en un folder con hoja de presentación. También deben cumplir con el tiempo establecido. No se recibirá esta asignación luego del día programado. Recuerda que el valor de este blog es de 50%.
I) Contesta las Siguiente Preguntas
1) ¿Qué es la química?
2) ¿Qué es química
orgánica?
3) ¿De dónde proviene el
término orgánica?
4) ¿Qué es la catenación?
5) ¿Es lo mismo carbono
que carbón?
6) ¿De qué forma puede
unirse el carbono?
7) ¿Cómo era la atmósfera
en la tierra?
8) ¿Cuáles son los
elementos que forman el cuerpo humano?
9) Lee el tema sobre “la formación
de los yacimientos de petróleo y de las minas de carbón”, y describe la forma
en que el petróleo se formó.
10) ¿Qué son los alótropos
del carbón?
11) ¿Cómo se forma el diamante?
12) ¿Cuáles son los usos
del grafito?
13) ¿Qué son los alcanos?
14) ¿Cuáles son los usos de
los alcanos?
15) ¿Qué son los alquenos?
16) ¿Cuáles son los usos de
los alquenos?
17) ¿Qué son los alquinos?
18) ¿Cuáles son los usos de
los alquinos?
II) Observa los Siguientes Videos y de Cada Uno Escribe un Resumen de Media (1/2) Página
Video 1:
Video 2:
Video 3:
Gersy Mora Perez
ResponderEliminar30/11/2017
Eliana tavera
ResponderEliminar30-11-2017
Yasmerlin Díaz
ResponderEliminar30-11-2017
Juan Alverto Santana
ResponderEliminar30-11-2017
Carolina Brito Mora
ResponderEliminar01-12-2017
Ismael villar
ResponderEliminar01-12-2017
Yeuri garsia
ResponderEliminar1/12/17
Luz maria Santana
ResponderEliminar01-12-2017
Franyeisi lajara
ResponderEliminar1/12/17
Omar taveras
ResponderEliminar01-12-2017
Juan Odalis
ResponderEliminar1/12/17
Karina Lajara Mena
Eliminar1/12/2017
ResponderEliminarFranyeisi Lajara
1/12/2017
Radeiry Rodriguez
ResponderEliminar1/12/2017
Alexander espinal
ResponderEliminar02/12/2017
Luis Al mando Portorreal
ResponderEliminar2/12/2017